药品生产过程中的容器、药包材的相容性研究
药品包装应满足药品预期目的的适用性要求。适用性包括了保护性、功能性、安全性和相容性。《药品管理法》明确指出“直接接触药品的包装材料和容器,应当符合药用要求,符合保障人体健康、安全的标准”。
药品与其直接接触的包装系统满足相容性要求,是保证药品质量的安全必须具备的条件之一。相容性研究则是评价包装组件或系统与药品直接接触后,没有发生严重的、或不可接受的导致药品有效性和稳定性发生改变,或者产生安全性风险的过程;研究内容包括包装材料或组件的可提取研究、药品与包装系统接触的影响的浸出研究和可能产生的对药品和辅料活性成分的吸附研究。
常用的包材种类有塑料、玻璃、金属和橡胶。由于药包材的种类、组成和配方不同,其物理和化学的性能差异很大,在其包装药物后对各类药物的影响也就不同,所以,对不同的药包材,在进行与药物相容性试验时的考察项目、采用的方法和结果的评价等也均不相同。

法规要求:
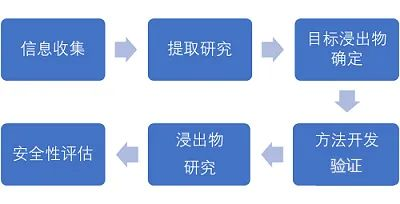
包材的信息收集评估
根据项目申请单的包装材料配方信息、生产工艺信息以及与药品有关的关键参数(如规格、给药途径、日最大摄入量等)为客户定制相容性研究方案。

提取物和浸取物研究
提取研究对于药包材相容性研究极其重要,提取研究主要有药包材的样品处理、提取溶剂的选择、提取条件的确定等。通过提取研究,尽可能获得更多的可提取物,对获得的相关可提取物进行鉴别、定量,预测药包材潜在的可浸出物。

常用分析技术
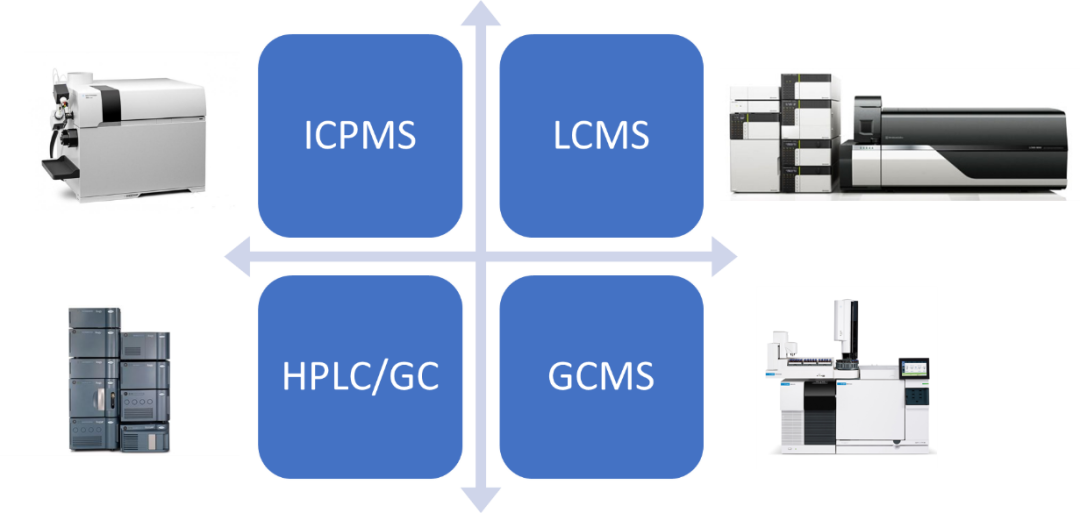
模拟试验和迁移试验应采用专属性强、准确、精密、灵敏的分析方法,以保证试验结果的可靠性;并应针对不同的待测项目选择适宜的分析方法。由于玻璃容器最常见的可提取物为金属离子、不挥发性物质等组分。
对可提取物和浸出物的常见分析方法包括:电感耦合等离子体发射光谱(ICP)、原子吸收光谱(AAS)、离子色谱(IC)、高效液相色谱(HPLC),以及与质谱的联机技术,ICP-MS、HPLC-MS等,方法学研究时重点关注灵敏度(检测限、基线值)、专属性、准确性等。
安全性评估
通过对提取研究和药包材的相互作用研究下,可以得知药包材和可提取物、浸出物及吸附效果的信息,有了这些信息可以得知,药包材是否会对药效产生影响、对药材辅料有吸附影响,是否会产生浸出物,从而对药品质量产生影响,从而得出药品材于药品的相容性的风险评价。
制药企业和药包材生产企业必须考察药品和包材之间的相容性,确保药品装在包装材料后不会发生迁移、渗透、腐蚀等情况,以保证药品有效性和稳定性,从而保障国民用药安全。
武汉世纪久海专注于药品包装及材料的检测研究,具有丰富的包材测试和研究经验,可为客户提供包材分析测试研发一站式服务,能有效助力企业让药品更快更安全的上市。




